
湖北日报讯(记者张真真)10月13日,武汉凯德维斯生物技术有限公司(以下简称“凯德维斯”)宣布,其自主研发的一类创新药KDTV001注射液新药临床试验申请,已获中国国家药品监督管理局批准,实现全球首创。同时,这一药物临床试验申请也于9月26日递交至美国食品药品监督管理局(FDA),并已进入审评阶段。
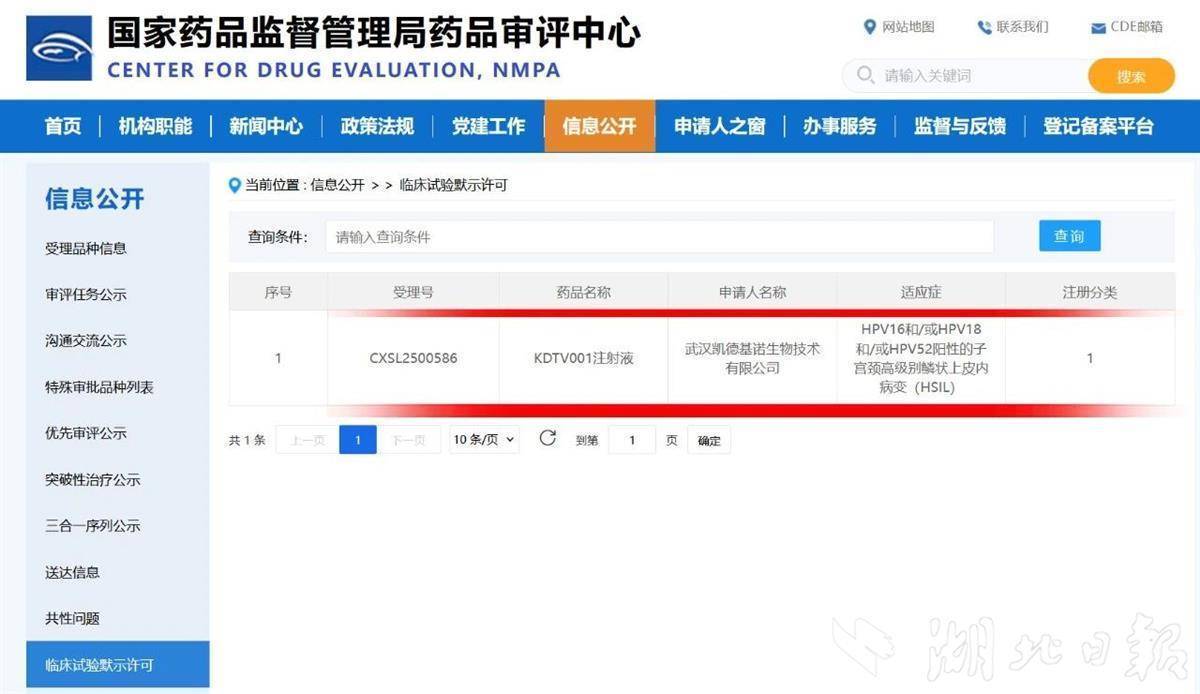
本次在中国获批的KDTV001注射液,为主动免疫类治疗用生物制品,将首先开展一项Ⅰ期临床研究,旨在评估该注射液在HPV16/18/52阳性的子宫颈高级别鳞状上皮内病变成年女性患者中的安全性、耐受性、免疫原性及初步疗效。
子宫颈癌是严重威胁全球女性健康的恶性肿瘤,在我国发病率高居第二位。2020年全球估计有60.4万例女性被诊断出患有宫颈癌,约34.2万例女性死于宫颈癌。
世界卫生组织发布的《加速消除宫颈癌全球战略》中明确提出,90%的确诊妇女应得到治疗。
高危型人乳头瘤病毒(HPV)持续感染是宫颈癌及癌前病变的主要驱动因素。尤其需警惕的是,子宫颈高级别鳞状上皮内病变(CIN2/3)的临床风险,是其最重要的癌前阶段。已有权威研究数据证实,未经治疗的CIN3患者在30年内有30%-50%会发展为子宫颈癌,且随着病程延长,这一风险还可能进一步累积,凸显了对子宫颈高级别鳞状上皮内病变进行早期、有效干预的紧迫性。

KDTV001注射液,将主要针对晚期实体瘤、早期非浸润性肿瘤、HPV感染导致的宫颈高级别鳞状上皮内病变等适应症。该注射液由凯德维斯旗下承担生物创新药物研究与开发的武汉凯德基诺生物技术有限公司负责研发。

凯德维斯是与华中科技大学同济医学院附属同济医院和马丁院士团队联合打造的国家级专精特新“小巨人”企业,已申请51项专利,含发明专利48项、实用性新型专利3项,并建立了从研发到生产的高效活病毒载体基因治疗药物全栈式平台,确保药物安全、有效、质量可控。2023年,其基因治疗药物重组溶瘤病毒KD01获得国家药品监督管理局批准,已进入Ⅰ期临床。
十大股票网站提示:文章来自网络,不代表本站观点。
- 上一篇:民间配资是“昆明水源牌”的基石
- 下一篇:没有了








